Senado FederalAprovada autorização de empréstimo de R$ 90 milhões paraa Santa CatarinaSenado FederalNovo marco legal para o comércio exterior vai à CâmaraSenado FederalSenado aprova criação de prêmio para mulheres empreendedorasSaúdeEspecialista diz que é cedo para alarme com vírus K no BrasilJustiçaSTF tem maioria para anular investigação contra governador do Acre
Brasil Anvisa
Anvisa autoriza uso emergencial e temporário de vacina contra covid-19
Anvisa autoriza uso emergencial e temporário de vacina contra covid-19
10/12/2020 14h26 Atualizada há 5 anos
Por: Redação
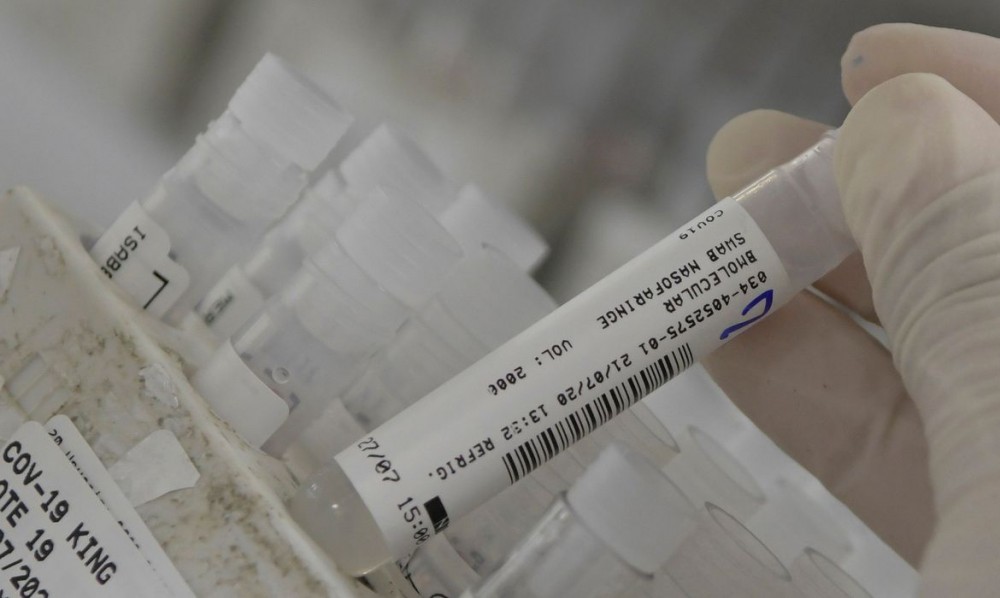
Autorização de uso emergencial é restrita a um “público definido"
Por Pedro Peduzzi - Repórter da Agência Brasil - Brasília
A Diretoria Colegiada da Agência Nacional de Vigilância Sanitária (Anvisa) aprovou uma resolução que “abre possibilidade aos laboratórios de solicitarem autorização para uso emergencial, em caráter experimental, de vacinas contra covid 19”.
 A decisão, deliberada hoje (10) durante a 11ª Reunião da Diretoria Colegiada, oficializa o pedido de uso emergencial de vacina anunciado no dia 2 de dezembro pela própria Anvisa. Segundo a agência, nenhum laboratório solicitou, até o momento, o uso mesmo após a Anvisa ter publicado um guia com os requisitos para esse pedido.
A decisão, deliberada hoje (10) durante a 11ª Reunião da Diretoria Colegiada, oficializa o pedido de uso emergencial de vacina anunciado no dia 2 de dezembro pela própria Anvisa. Segundo a agência, nenhum laboratório solicitou, até o momento, o uso mesmo após a Anvisa ter publicado um guia com os requisitos para esse pedido.

 A decisão, deliberada hoje (10) durante a 11ª Reunião da Diretoria Colegiada, oficializa o pedido de uso emergencial de vacina anunciado no dia 2 de dezembro pela própria Anvisa. Segundo a agência, nenhum laboratório solicitou, até o momento, o uso mesmo após a Anvisa ter publicado um guia com os requisitos para esse pedido.
A decisão, deliberada hoje (10) durante a 11ª Reunião da Diretoria Colegiada, oficializa o pedido de uso emergencial de vacina anunciado no dia 2 de dezembro pela própria Anvisa. Segundo a agência, nenhum laboratório solicitou, até o momento, o uso mesmo após a Anvisa ter publicado um guia com os requisitos para esse pedido. “Serão considerados dados de estudos não clínicos e clínicos, de qualidade, boas práticas de fabricação, estratégias de monitoramento e controle e resultados provisórios de ensaios clínicos, entre outras evidências científicas. Além disso, a empresa deve apresentar informações que comprovem que a fabricação e a estabilidade são adequadas para garantir a qualidade da vacina”, informou, por meio de nota, a Anvisa.A agência esclarece que a autorização de uso emergencial e temporária é restrita a um “público previamente definido”, não substituindo o registro sanitário.
“A modalidade de uso emergencial e temporário está prevista em regulamento e pode trazer benefícios a determinados e controlados grupos, como medida adicional para o enfrentamento da pandemia. O pedido de uso emergencial e temporário deve ser submetido pela empresa desenvolvedora da vacina contra covid-19”, detalhou a Anvisa.
Edição: Kleber Sampaio
Nenhum comentário
Mostrar mais comentários
* O conteúdo de cada comentário é de responsabilidade de quem realizá-lo. Nos reservamos ao direito de reprovar ou eliminar comentários em desacordo com o propósito do site ou que contenham palavras ofensivas.
Veja também
 Nota de Pesar Nota de pesar — Marcos Pereira da Cruz
Nota de Pesar Nota de pesar — Marcos Pereira da Cruz  Criança Adolescente MDHC defende proteção integral e direitos de crianças e adolescentes no 25º Encontro Nacional do PPCAAM na Paraíba
Criança Adolescente MDHC defende proteção integral e direitos de crianças e adolescentes no 25º Encontro Nacional do PPCAAM na Paraíba  Senado Federal Efraim assina urgência de projeto que defende o Agro e proíbe a desapropriação de terras produtivas
Senado Federal Efraim assina urgência de projeto que defende o Agro e proíbe a desapropriação de terras produtivas  Politica Efraim é eleito o melhor senador do Brasil pelo Ranking dos Políticos 2025
Politica Efraim é eleito o melhor senador do Brasil pelo Ranking dos Políticos 2025  Segurança “Político que se junta com traficante não representa o povo, representa o crime”, dispara Efraim
Segurança “Político que se junta com traficante não representa o povo, representa o crime”, dispara Efraim  Maniaus Mulher aluga carro de luxo para atrair homens e roubá-los durante sexo
Maniaus Mulher aluga carro de luxo para atrair homens e roubá-los durante sexo Novo Gama, GO
Atualizado às 22h10
19°
Chuva
Mín. 18° Máx. 27°
20° Sensação
3.09 km/h Vento
99% Umidade do ar
100% (8.32mm) Chance de chuva
Amanhã (19/12)
Mín. 18° Máx. 25°
Chuva Amanhã (20/12)
Mín. 16° Máx. 19°
Chuvas esparsas Mais lidas
1
Política - Há 5 dias Efraim recebe título de cidadão pirpiritubense e reforça compromisso com o município A solenidade contou com a presença do prefeito Danilo Rocha (União Brasil), do vice-prefeito Marcos Terto, vereadores, secretários municipais, lideranças políticas e representantes de comunidades urbanas e rurais
2 Política - Há 5 dias Motta elogia servidora alvo da PF e diz que Dino não aponta desvio
3 Geral - Há 3 dias Quatro dias após ventania, SP tem mais de 60 mil clientes sem luz
4 Senado Federal - Há 3 dias Presidente do Congresso lamenta ataque a judeus na Austrália
5 Saúde - Há 5 dias Um em cada 10 agentes penitenciários teve diagnóstico de depressão

© Copyright 2025 - Jornal BNEWS - Todos os direitos reservados










